論文2: 訳 河田昌東
スクレーピーの増殖と適応に先行する長期の潜在的キャリア状態が存在
牛海綿状脳症及びヒト変異型クロイツフェルト・ヤコブ病との類似性
Long‐Term
Subclinical Carrier State Precede Scrapie Replication and Adaptation ina Resistant
Species:Analogies to Bovine Spongiform Encephalopathy and Variant Creutzfeldt−Jacob
Disease in Humans
Journal
of Virology, Vol.75, No21, p10106−10112(2001)Nov.
Richard
Race, Anne Raines, GregoryJ, Raymond, Byron Caughey
要旨:
BSEに感染した牛は人間への変異型クロイツフェルト・ヤコブ病(以下vCJDと記す)の伝達媒体と考えられている。 これまで100人以上の人々がvCJDを発病したが、数百万人が恐らくBSE感染牛の摂取によって感染の危険にさらされた。 このうち何人が実際に発病し、将来他人を感染させる潜在的なキャリアとして働くのは何人か、現在は分っていない。
我々は、スクレーピーにかかったハムスター(263K株)の脳組織を接種したマウスのモデルを使って、種間感染後の感染性因子の持続性と適応力を調べた。マウスは1000万ハムスター感染単位(訳注)を接種してもスクレーピーの臨床症状を発症しなかったが、ハムスターへのスクレーピー感染力は、マウスの生涯にわたって脳や脾臓の中で持続し続けた。この研究で我々は感染から1年経ってもマウスの脳内で感染性因子の増殖の証拠が得られないことを発見して驚いた。逆に、この不活性の潜伏期間のあとには、感染性因子の活発な増殖とマウスを死に至らしめうる新たな感染性因子への適応が続いたのである。大部分のマウスでは初期の潜伏期でも後期の増殖期でも蛋白質分解酵素耐性のプリオン蛋白質(異常プリオン)を抗原抗体反応(イムノブロット)で検出することは出来なかった。もし同様の無症状キャリア状態が人間や他の動物へのBSEの感染で起こるなら、これは更なるBSEの拡散、即ち汚染した血液や手術器具、あるいは肉によるvCJD感染の危険性を著しく増加させる。 もし、そのような無症状キャリアが、我々のマウスの実験のように異常プリオン陰性なら、最近行われている脳、扁桃腺、その他の動物や人間の組織を、抗原抗体反応や免疫組織化学的方法でスクリーニングしても、感度が低すぎてこれらの無症状個体を同定することは出来ない。
(訳注:50%の被検動物を発症させる希釈倍率、この場合はスクレーピーのハムスターの脳組織を1000万倍希釈しても他のハムスターの群の50%を発症させる量)
本文:
種間感染後の異常プリオンの分析:
最初、C57BL/10株のマウスの脳内に、1000万ID50単位のスクレーピー・ハムスターの脳組織(1%の脳組織懸濁液50μリットル)を接種した。第2世代、第3世代の接種ではそれぞれ前の世代のマウスの脳組織を同様に接種した。接種後、最長782日まで観察し、随時解剖して組織の検査と異常プリオン検出を行った。第1世代の接種では、接種直後(0.1日後)にはまだハムスター型の異常プリオンは脳内で検出可能であったが、5日以降782日までハムスター型異常プリオンは一例も検出できなかった。逆に、310日目からマウス型異常プリオンが検出され始め(2個体の中1個体)、574日目には16個体のうち7体、782日では2個体全部でマウス型異常プリオンが検出された。ハムスター型異常プリオン検出にはマウス型とは交差反応しないモノクローン抗体(3F4)を、マウス型異常プリオン検出にはハムスター型と反応しないポリクローン抗体(R30)が使われた。こうした結果から、接種後期に現れた異常プリオンは、最初に接種したハムスターの異常プリオン由来ではなく、新たにマウス脳内で増殖したものと考えられる。しかしながら、異常プリオンが検出されなかった個体も検出された個体も、いずれもマウスにスクレーピーの臨床症状は起こさなかった。その理由は多分、検出された異常プリオンの濃度が、マウスで臨床症状を起こすとされている濃度の4分の1から100分の1程度だったからであろう。
ハムスターへの感染力の検出:
一般に異常プリオンと感染性には関連があることから、異常プリオンが検出されたマウスには高い感染力があると考えられる。しかし、我々は異常プリオン陰性の無症状個体でもハムスターに感染力があるかどうかに関心をもった。こうしたキャリアー個体の存在は、感染性の実験でしか検出できず、BSEで汚染した飼料による交差感染(種間感染)でおこる問題のモデルになりうると考えたからである。それで、接種後の色々な時間に異常プリオン陰性の第1世代マウスの脳組織をハムスターの脳に接種した。接種したすべての試料が典型的なスクレーピーの症状をハムスターに起こした(図1a)。しかしながら、その感染力の強さには大きなばらつきがあった。例えば、0.1日と5日目の第1世代マウスを接種したハムスターでは発病までの潜伏期間が短く、感染力も大変強かった。20日目から390日目に至るにつれて、そのばらつきが目立ち始め、日が経つにつれて次第に発病までの潜伏期間は長く、ばらつきも大きくなり、感染力が小さくなったことを示している。しかしながら、その後463日から782日目のマウスの脳を接種したハムスターはすべて発病し、発病までの潜伏期間も120日から230日と短縮した。これは感染力が再び非常に強くなったことを示している。接種するマウスの脳組織の希釈実験から、この第1世代のマウスの後期の脳は、ハムスターに対する感染力が100倍以上増加したことを示している。本来のハムスターのスクレーピー263K株の脳を色々に希釈して接種したハムスターの発病潜伏期間にはこうしたばらつきは無く(図1b)、第1世代マウスの中で生じたスクレーピー感染性因子は、もとの263株とは違うことを示唆している。
マウスの継代接種における感染性の検出
第1世代マウスの異常プリオン陰性の脳組織にマウスに適応した感染性があるかどうか調べるために、さらに続けて次世代以降のマウスへの接種実験をおこなった。ハムスターの場合に高い感染力を示したのとは対照的に、マウスでは782日目のドナー以外どれもマウスに臨床症状を起こさなかった(表2)。興味深いことに、この782日目のドナー・マウスの脳組織は、263K株同様の短い潜伏期間でハムスターに感染性を示し(図1a)、この脳組織にはハムスターの263K株の感染因子とマウスに適応した感染因子の混合物の存在の可能性を示唆している。
第2世代マウスにも異常プリオンが出来るかどうか検査した。130日目に解剖し陰性だった第1世代マウスの脳を接種した場合、650日から750日まで検査しても異常プリオンは見つからなかった(表2)。それに対して、もっと遅い時期(463日から693日)に脳組織を取った異常プリオン陰性の第1世代マウスの場合、36匹の宿主(第2世代)のうち20匹が明らかに異常プリオン陽性になった(表2)。このことは、臨床症状の出ない異常プリオン陰性のマウスが第2世代に感染性を伝達したことを示している。従って、キャリアの第1世代マウスでは、接種後相当時間が経ってから初めてハムスターへの感染性因子の増殖とマウスへの適応が検出可能になる。782日目の異常プリオン陽性の第1世代マウスの脳を接種された第2世代マウスは、異常プリオンも陽性、スクレーピーの臨床症状も生じた(表2)。この宿主は457±15日で死亡した。それに対して、同じ脳組織の接種をうけたハムスターは122日から134日の間に死亡した(図1a)。
これらの実験におけるマウスとハムスターのスクレーピー感染因子の出現をさらに調べるために、接種後650目日から750日目の第2世代のマウス8匹の脳組織を採取し、さらにマウスとハムスターへの感染性を分析した。現在までに、400日間観察を続けているが、接種後130日目に殺した第1世代マウス由来の第2世代のドナー1と2は感染性が観察されていない(表3)。従って、130日目の第1世代マウスはハムスターに対する感染力はあるがマウスに対しては感染力を持たない(表2と3)。3匹の第2世代ドナーはハムスターに100%発病させる能力を保持していた(574日目のマウスのドナー1と2、及び782日目-1のマウス:表3)。これらのドナーの中、2匹(574‐2と782-1)の感染性はマウスに対しても100%の死亡率を示した(表3)。 これらのドナーについて、2種類の生物に感染性をもつ新しいスクレーピーの株が1種類あるのか、あるいはマウスとハムスターにそれぞれ感染する別のスクレーピー株が同時に発生したのかは不明である。
これらの結果とは対照的に、693日目のドナー1から取った脳組織は、ハムスターにはほとんど感染性を示さず、ほぼ完全にマウスに適応したように見える(潜伏期間は183±22日)(表3)。この第3世代マウス2匹から取った脳組織は、第4世代のマウスに接種されたが、潜伏期間は118±3日と120±3日で、ハムスターに対する感染性は検出できなかった(データなし)。このことは、この株がマウスに対する毒性に向けて適応を継続させたことを示唆している。
ゲル電気泳動上で異常プリオンの糖鎖の違いによるサイズと量比の違いで、スクレーピーの株の特徴を区別できることが知られている(文献4、9、13)。プリオンの糖鎖の変化を調べる目的で、我々は表3に示した574日目、693日目、782日目のドナー由来の第1世代、第2世代、第3世代マウスの異常プリオンを分析した。これらのマウスの異常プリオンのゲル上のバンド・パターンは様々だが、典型的な263K株に感染したハムスター及びシャンドラー/RMLに感染したマウスの異常プリオンとは区別することが出来た(図2a:写真につき省略)。第3世代マウスの試料をホスホ・イメージャーで定量すると、693-1ドナーのバンド中の異常プリオンの%は574-2のものとも782-1のものとも有意に違っていた(図2b:省略)。これは先に述べたように、新しい(マウス型の)株が発生したという結論を支持する結果である。
組織化学的分析もいくつかの第3世代マウスで行い、病理学的分布即ち異常プリオンの局在的変化が起こっているかどうか調べた。これまでに、スクレーピーの株の違いとそうした病理学的分布の違いが関連している、と報告されている(文献6)。 我々が調べたのは表3で示した574-2、693-1、782-1の第2世代のドナーの脳組織を接種されたマウスである。すべてのマウスが同じ変化を示していて、脳幹、下丘(posterior colliculus),視床で広範な海綿状態と大グリア細胞症(astroglyosis)を示していたが、一方、海馬、大脳皮質、小脳皮質では病理学的変化は少なかった。693-1ドナーの脳組織を接種されたマウスでは、異常プリオンの蓄積は主に視床と下丘にあり、その他の宿主では、重篤な異常プリオンの蓄積は視床下部、海馬、あるいは脳幹でも見られた(表4)。 この結果は、これらの別々の宿主ではそれぞれ異なるスクレーピー株が発生した、という結論にさらに支持を与えるものである。
討 論
この実験で、ハムスター由来のスクレーピー感染性は、マウスでもほぼ4年間にわたる2回の継代接種中に複製することがわかった。この結果は、263K株のハムスター・スクレーピーはマウス中では複製せず、最初に接種した病原体が持続するだけだ、というKimberlin らの結果(文献17)と著しく異なる。我々の結果との違いは唯一、彼らのマウスによる継代実験が319日、158日、152日間で、我々が第2世代マウスで感染性を見つけたのは463日以降になってからであった、という点だけである。
我々の結果は最近の研究(文献11)を更に拡張するものである。この研究では、ハムスター・スクレーピーを感染させた2匹のマウスの脳組織の感染性の力価(訳注:定量値)を分析している。そのうちの一匹は異常プリオン陰性であったが、感染性レベルは元の接種量の20分の1であって、当初接種したものの痕跡であろうと考えられた。ところが、もう1匹の異常プリオン陽性のマウスでは、最初に接種した量の5倍も多い感染性力価が検出され、このマウスでは感染性因子が増殖したことを示していた。23匹のマウスを使い、2年以上の観察を続けた我々の分析では、接種後最初の1年間はハムスター・スクレーピーの感染性因子がマウスの中で増殖するという証拠は得られなかった。最初の接種による残留感染性は数時間の間だけ検出されたが、次の数ヶ月間に次第に減少していった。感染性の増加がはっきり見られたのは463日目を過ぎてからで(図1a)、この時点ではまだ異常プリオンは陽性にならなかった。その後、次第に適応が進むにつれてマウスに対する毒性が増加し、感染性の増加が明らかになった。このように、我々の実験では無症状の潜伏期間中のマウスには二つの異なる相が区別できる。はじめの持続的な相(期間)に続いて複製する相(期間)がくるが、異常プリオンはどちらの相でも信頼できるマーカーにならない。
明らかに、継代接種マウスにおける適応は第1世代のマウスでは長い時間のかかるゆっくりした過程である。しかし、一旦適応が進行すれば我々が観察したのとKimberlinらが見たのとは同じである(文献15〜17)。少なくとも二つの異なるプリオンの株が我々のマウスでは出現したように見える。1つはマウスに感染性を持つがハムスターには感染性をもたない(表3、ドナー693)。もう1つの株はハムスターには毒性を発揮するが元のハムスターの263K株とは違うもので、ハムスターには長い潜伏期間が伴う(180日と197日)が、ハムスターを100%殺す感染力をもつ(表3、ドナー574-2と782)。この同じ動物ではマウスへの感染性も見られ、潜伏期間は314日と320日であった。 これは別個の株によるのかもしれないが、両方の種に毒性をもつ単一の新たな株かもしれない。この二つの可能性を区別するには、限定希釈クローニングが必要であろう(文献15)。
ハムスター・スクレーピーのマウスへの適応は、この実験では感染後2年目に起こったが(表2)、第1世代マウスに存在する感染性の大部分で、ハムスターへの毒性はそれまでの期間中ずっと維持されていた。その上、この感染性因子の増殖は(その期間)ハムスターの異常プリオンが検出されなくても起こった。こうしたデータは、もし、その感染性因子が核酸ゲノムを持ち、新しい種への適応のための突然変異を起こすことが可能な、従来型のウイルスであると仮定すれば容易に説明できる。しかしながら、異常プリオンが感染性因子で、種適合性は新しい異常プリオンを作るのに使われる正常プリオンに依存する(文献8)、というプリオン仮説との整合性はより困難である。この仮説との整合性を保つには、(最初に接種された)ハムスターの異常プリオンは、2年後に起こる複製期に、蛋白質分解酵素感受性のマウスの正常プリオンから出来る新たな異常プリオンに、そのユニークな構造特性を刻印しなければならない(文献1、3〜5、7、9、23)。今はこの可能性を立証し、あるいは排除するには異常プリオンの構造に関する情報が不充分である。
そうした長期間にわたる持続と適応の能力は、多くのTSE感染因子に共通かもしれない。
さらに、TSE病が種の壁を超えて伝達される野生生物や家畜の双方において、無症状感染と予期せぬ適応、あるいは他の種への拡散につながるような他の要因もある。例えば、羊のスクレーピーは人間にはリスクがないと考えられているが、ヨーロッパにおけるBSEの原因かもしれない、とは言われている(文献24,25)し、恐らくアメリカのCWD(シカの海綿状脳症)の原因とも考えられている。 BSEが仮に羊のスクレーピーから来たとしたら、牛への伝達期間中に適応性が増し、人間への病原性を増加させたかもしれない。同様の状況がCWDにもありうる。CWDは他のシカ科の動物や家畜への伝達によってその性質を変え、人間への感染性を獲得するかもしれない。
BSEに潜在的に感染した人の数に比べて発病した人の数が少ないことから示されるように、BSEに暴露された人間は変異型クロイツフェルト・ヤコブ病の発症に何がしか抵抗性を持つかもしれないが、こうした発症しない個体の多くには無症状キャリア状態の存在が懸念される。この研究結果とのアナロジーで言えば、その可能性は確実にあり、もし事実ならば複製や適応の危険、これらの人々から他の人々への感染性因子の拡散の危険は暴露後長期間経ってからむしろ増加するかも知れないのである。その上、BSEの人間への感染量についての厳密な情報が無いので、人間集団内の無症状キャリアの数を予測することも不可能である。わずかなレベルの感染性因子しか発現していないので、こうした無症状キャリア状態は感染性の伝達実験でしか検出できず、現在の生化学的方法では検出を免れてしまうだろう。従って、無症状キャリア患者は、外科手術器具や組織移植、血液製剤における汚染という重大なリスクをもたらすだろう。BSEやその他のTSE病が将来拡散しないようにするために、こうした新しい潜在的リスクに注意することが大切である。
文献(省略)
表1:接種第1世代マウスにおける異常プリオンの検出と発症
![]() 日数 発症 ハムスター型 マウス型
日数 発症 ハムスター型 マウス型
異常プリオン 異常プリオン
![]() 0.1 0/2 2/2 NT(検査せず)
0.1 0/2 2/2 NT(検査せず)
5 0/2 0/2 0/2
20 0/2 0/2 0/2
60 0/2 0/2 0/2
130 0/2 0/2 0/2
240 0/2 0/2 0/2
310 0/2 0/2 1/2
463 0/3 0/3 0/3
574 0/16 0/2 7/16
693 0/13 0/2 3/13
782 0/2 0/2 2/2
![]() 分子は発症または検出個体数、分母が被検数
分子は発症または検出個体数、分母が被検数
表2: 接種第2世代マウスにおける異常プリオン検出と発症
![]() 日数 第1世代マウス 第2世代マウス
日数 第1世代マウス 第2世代マウス
![]()
![]() ドナー数 異常プリオン 発症 異常プリオン
ドナー数 異常プリオン 発症 異常プリオン
![]() 130 1 − 0/12 0/6
130 1 − 0/12 0/6
130 2 − 0/12 0/7
463 1 − 0/6 3/6
463 2 − 0/6 3/6
574 1 − 0/10 5/6
574 2 − 0/10 4/6
693 1 − 0/9 3/6
693 2 − 0/10 2/6
![]() 782 1 + 10/10 8/8
782 1 + 10/10 8/8
表3: ハムスターとマウスによる第3世代マウスの分析
![]() 第1世代 第2世代の 第3世代の受容体
第1世代 第2世代の 第3世代の受容体
![]() マウスの ドナー・マウス ハムスター マウス
マウスの ドナー・マウス ハムスター マウス
![]()
![]()
![]() 日数 数 異常プリ 発症 潜伏期間(日) 発症 潜伏期間(日)
日数 数 異常プリ 発症 潜伏期間(日) 発症 潜伏期間(日)
130 1 − 0/12 >400 0/12 >400
130 2 − 0/12 >400 0/12 >400
463 1 − 0/12 >400 0/12
>400
463 2 + 1/12*
>400 0/12 >400
574 1 + 12/12
215±11 0/12 >440
574 2 + 12/12 180±2 10/10 314±18
693 1 + 1/12** >440 12/12 183±22
782 1 + 12/12 197±12 12/12 320±10
![]()
* この1匹は231日目に発症
** この1匹は245日目に発症
表4: 3種類の第2世代マウスからの脳組織を接種した第3世代マウスの
脳の各部の異常プリオンの分布
![]()
脳の部位 分析結果
![]()
![]() 574-2 693-1 782-1
574-2 693-1 782-1
視 床 + ++ ++
脳 幹 + + ++
下 丘* ++ ++ ++
視床下部 ++ + ++
大脳皮質 − − −
小 脳 + − +
海 馬 ++ − −
![]() * 中脳の聴覚をつかさどる場所
* 中脳の聴覚をつかさどる場所
図1a(上):ハムスター.スクレーピー263K株を接種した第1世代マウスのハムスターへの感染の潜伏期間分析
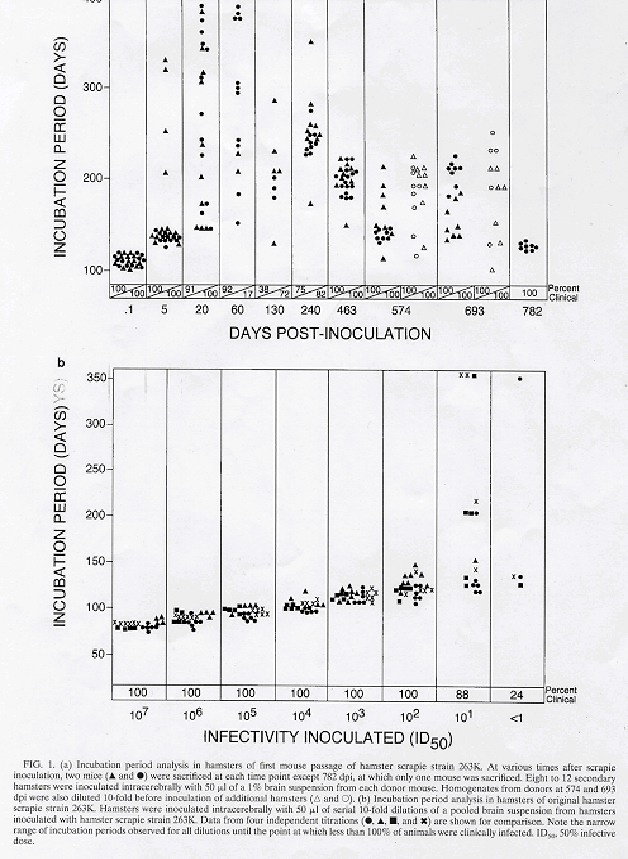
図1b(下):元のハムスター.スクレーピー263株のハムスターへの接種における潜伏期間分析