プリオンが検出できなくても、BSEは感染する?
河田昌東
現在、BSE及びそれが原因と見られるヒト変異型クロイツフェルト・ヤコブ病の病原体は遺伝子を含まないプリオン蛋白質だというのが定説である。それで、異常プリオンが検出されなければ危険性はない、というのが「安全性」の根拠とされ、いわゆる牛の全頭検査で安全性は確保された、というのが日本政府の公式見解である。しかし、少なくない研究者が、プリオンを検出できないにも関わらずBSEの感染が起こる、という論文を発表している事実は何を示すのだろうか。現在、使われている「イライザ法」や「ウエスタン・ブロット法」における検出限界が高すぎて異常プリオンが少量あっても検出できないのか、あるいは一部の研究者が主張する、プリオン以外の要素が関与しているのか。
ここでは、あえて、プリオンが検出されないにも関わらず感染性が証明された論文をいくつか紹介し、今後の議論の参考としたい。
論文1:訳 河田昌東
異常プリオン蛋白質が検出できなくてもBSE病原体は伝播する
Transmission
of the BSE Agent to Mice in the Absence of Detectable Abnormal Prion Protein: Science Vol.275, p402, 17 January 1997.
Corinne
I. Lasmezas, Jean-Philippe Deslys, Oliver Robain, Alexandre Jaegly, Vincent
Beringue, Jean-Michel Peyrin, Jean-Guy Fournier, Jean-Jacques Hauw, Jean
Rosseir, Dominique Dormont
要約:
伝染性海綿状脳症(TSEs)の原因物質は、正常な細胞の蛋白質プリオン(PrP)が蛋白質分解酵素に抵抗性のある異常型(PrPres)に変わったものである、と考えられている。この論文ではBSE(牛海綿状脳症)のマウスへの種間伝達を研究した。BSEに感染した牛の脳組織のホモジェネート(訳注:ミキサーで破砕した細胞のジュース)を接種したマウスはすべて神経症状を起こし、神経死に至ったが、そのうち55%以上のマウスで異常プリオン蛋白質は検出されなかった。継代接種を続ける間に、この感染因子は新しい宿主に適応し、異常プリオンが現れるようになった。従って、異常プリオン発生には種間適応現象が関わっているかも知れないが、実際には何か未知の因子がBSEの感染に関与しているかもしれない。
本文:
BSE感染因子の明らかな特徴の1つは、他の生物種への高い感染性である(文献1〜3)が、牛以外の他の生物のTSEの感染因子は同一種内でしか簡単には感染しない。この種の壁が種間伝達における長い潜伏期間の原因となっている(文献4)。実験的に継代接種を続ければ、TSE感染因子は新しい宿主に適応し、潜伏期間も短くなり、安定した病理学的症状が得られるようになる(文献5)。プリオン仮説に従えば、異常プリオン(病原性をもち、蛋白質分解酵素に抵抗性のプリオン蛋白質)がTSEの感染因子であって、その増殖には病原性プリオン蛋白質分子と正常なプリオン蛋白質分子の間の相互作用によって、正常型が異常型に構造変換する、という過程が関与している。従って、種の壁の高さはプリオンのドナー生物と受け手の宿主生物のプリオン同士の相性の度合いによるらしい(文献6)。しかしながら、このメカニズムはBSEの感染因子が例外的に種の壁を超えられる説明にはなっていない。BSEの感染因子は、もともとそうした性質を持っていて、人間にも感染したものと疑われている(文献2、7)。それで、我々はBSEの伝播と異常プリオンの挙動を、マウスへの最初の接種の時から、それ以降の継代接種マウスまでわたって調査した。
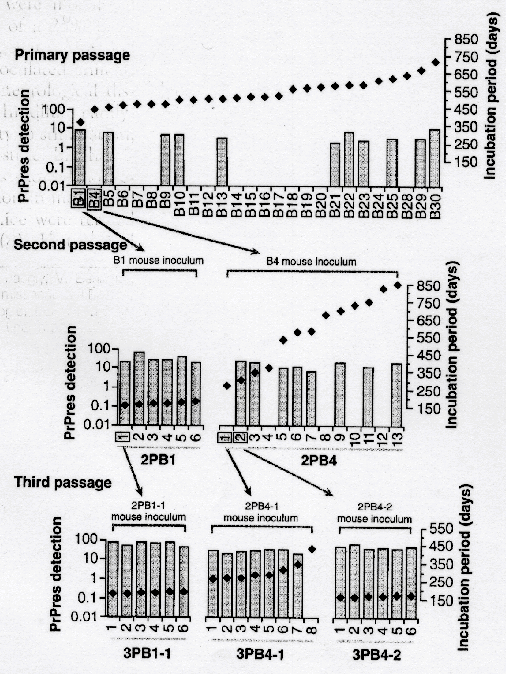
30匹のC57BL/6株のマウスの脳内にBSE感染牛の脳の25%ホモジェネートを接種した。 368日から719日後にはすべての接種マウスが後足の麻痺や震せん、刺激に対する過剰反応、無関心(アパシー)、体を弓なりにそらす、などの神経病症状を示した。これらの個体の脳の生化学的分析では、マウスの55%以上に異常プリオンの蓄積は見られなかった;即ちこれらのマウスは異常プリオン陰性と評価されたのである(図1省略、及び図2)(文献8:訳注 文献8は著者らのコメントである。ここで、著者らは、この結果に対して、マウスを殺すのが早すぎた、という反論が出るかもしれないが、事実上これらのマウスは症状が進行して死亡直前になってから解剖したし、また神経症状が出る前には異常プリオンの蓄積が見られる、という論文があるので、解剖が早すぎたと言う批判は当たらない、と反論している)。
組織学的検査結果ではすべてのマウスで神経死が明らかであった。しかし、その他のTSEに伴う典型的な変化、即ちニューロンの空胞化と星状細胞増加症は異常プリオン陽性のマウスにしか見られなかった(図3 省略)。ニューロンの消失は小脳のパーキンエ細胞において最も顕著であったが、海馬のCAI領域でも規模は小さいが観察された。局所的な炎症は何処にも見当たらなかった。退縮した細胞の電子顕微鏡による検査では、I型アポトシスに特徴的なクロマチンの周辺化(marginalization)と塊化(clumping)が見られた(図3E)(文献9)。
異常プリオン陰性のマウスもTSEに感染していたという理由は、それら(の脳組織)もまた典型的なTSE症状、即ち異常プリオンの蓄積と海綿状病変を示す病気を次世代に伝達することが出来たからである(図2)。異常プリオン陽性のマウス(例えば図2のB1)と陰性のマウス(例えば同図のB4)の脳組織を第2世代のマウス(の脳)に接種した。異常プリオン陰性マウスからの脳を接種されたマウスも大部分は典型的なTSEを発症したが、再び異常プリオン陰性のものも少数あり、潜伏期間も長いままだった。しかしながら、第1世代のマウスでも観察されたように、第2世代でも異常プリオン陽性のマウスも陰性のマウスも潜伏期間の長さは同程度であった(図2)(文献10)。異常プリオン陽性のマウスの脳組織による伝達では、潜伏期間の短縮と均一化(平均167±2日)という重要な現象に加え、すべてのマウスで異常プリオン陽性となった(図2)。
第3世代の伝達は、B1由来のマウス(訳注:第1世代で異常プリオン陽性)1匹と、B4由来(訳注:第1世代で異常プリオン陰性)のマウス2匹を使ったが、B4由来の2匹のうち1匹だけが陽性である(図2)。異常プリオン陰性のマウスの脳の接種の場合、第3世代における発症の潜伏期間は短縮し、変動幅も少なくなったが、1匹を除いてその他すべてのマウスが発症終期では異常プリオン陽性となった。異常プリオン陽性マウスの脳を接種した場合は、元々の由来が陽性であろうと陰性であろうと関係無く、潜伏期間は非常に良く似ていた。また、この第3世代の伝達の結果、異常プリオン陰性のパターンはほとんどなくなった(図2)。
このように、異常プリオン陽性のパターンには選択的優位性があり、潜伏期間の短縮と均一化に関与したといえる。従って、異常プリオンは新しい宿主への感染性因子の適応に関わっている。
我々は3世代にわたって、異常プリオンが検出出来ない状態でもTSEを伝達できたのであるから、感染性と異常プリオン(の検出)は別問題である(文献11も参照)。異常プリオン陰性と陽性のマウスで臨床症状が似ていることは、ニューロン死が中枢神経系機能障害の主原因であることを示唆している。しかしながら、海綿状病変と明らかなグリオシス(神経膠症)の存在は異常プリオンの存在と直接結びついていた(文献12)。脳病変における異常プリオンの役割はこれまで試験管実験で示されてきた(文献13)し、病気と病理学的病変の発生には正常プリオンが必要であることも示されてきた(文献14、15)。従って、異常プリオンは明らかにTSEの病理学的過程に関与している。しかしながら、それは感染性因子の伝達成分ではないかも知れない。
この考えは、TSEの株に多様性があることで支持される。 例えば、遺伝的に同一のC57BL/6マウスで、8つ以上の異なるTSE株が増殖可能で、宿主の正常プリオンが同じにも関わらずそれぞれ特有の性質(潜伏期間、病巣の分布、生化学的な特徴など)を示す(文献16、17)。ある株は、異なる正常プリオン分子をもつ別の宿主生物にたいしても、伝達の結果、その株に固有の性質を保持することさえある(文献1、16)が、一方、別の株は1種類の宿主に伝達しても表現型に変化を生ずるものもある(文献18)。最後に、プリオンを持たないマウス(訳注:遺伝子操作で作出)に接種した場合、チャンドラー・スクレーピー株(訳注:羊由来)を使っても、あるいはマウスに適応したクロイツフェルト・ヤコブ病のFukuoka−1株(訳注:ヒト由来)を使っても、どちらも臨床症状を生じなかった。しかし、いくつかのマウスの脳では接種から20週間後でも感染性因子を保持していた(文献14、19)。
我々はBSEの感染性因子の種間伝達の場合、脳内に異常プリオンの蓄積が検出できなくてもTSEの伝達が出来たのであるから、異常プリオンに加えて(別の)感染性因子が存在すると言う仮説もありうる。TSE株の多様性を考えれば、この因子は核酸かもしれない。さらに、我々の結果は、病理学的なメカニズムがBSEの因子の種の壁を超えた感染の特異な効率性を説明するかもしれないことを示唆している。BSE因子は異常プリオンの蓄積が無くても新たな宿主で十分増殖出来るほどの毒性がある。つまり、それは排除されずに存在し続け、増殖中に新たな宿主の正常プリオンを異常プリオンに変換させる能力を獲得するのかも知れない。この適応現象の結果、感染性因子は異常プリオンにしっかりと結合し、毒性を発揮し、典型的な海綿状病変の発達を誘発するのであろう。
(文献 省略)
論文1の図2