Science vol.296, Number5577,p2386−2388(28 June 2002)
商業用栽培圃場における花粉を媒介とした除草剤耐性遺伝子の移動
Mary A. Rieger、
Michael Lamond、Christopher Preston、 Stephen B. Powles、
Richard T. Roush1
全訳 河田昌東
遺伝子組換え作物に関して一般の人々と科学者の間で賛成、反対双方の立場から大きな論争がある。GM作物の最初の1つであるキャノーラ・ナタネ(Brassica napus)は今では北アメリカで広く栽培され、オーストラリアやヨーロッパへの商業用輸入が申請されている。反対派の懸念は、花粉がGMからNON−GM作物や近縁種の雑草に組換え遺伝子を伝播し、受け入れられないレベルまで汚染が起こるのではないか、というものである。
従って、GM作物の環境影響を評価するには、花粉の媒介する遺伝子流出を定量的に調べる事が必要である。本研究は、除草剤耐性キャノーラから近隣の除草剤耐性を持たないキャノーラに遺伝子が圃場レベルでどの程度流出するかを定量的に調べたものである。
本文
花粉の飛散に関するデータのほとんどは小規模の野外試験による(文献1〜5)。GMキャノーラを使ったカナダの実験では在来種への花粉の伝播は30メートルで0.03%以下しかなかった(6)。しかし、HallらはGMキャノーラの花粉が遥かに遠くまで移動すると示唆している(7)。 従って、我々は除草剤耐性キャノーラと在来種との間の花粉の移動を、4800万株以上の商業栽培スケールで調査した。これが可能だったのは、アセトラクテート合成酵素(ALS)を阻害する除草剤に耐性のキャノーラがオーストラリアで2000年に初めて商業栽培されたからである。この最初の商業栽培畑は非汚染環境中で除草剤耐性遺伝子の供給源となった。この品種は除草剤耐性遺伝子を二つのゲノム上に持っているホモ接合体である。それで、在来種とどのように交配してもどちらか一方の遺伝子は伝わることになる。
遺伝子の流出を評価するために、ニューサウスルエールズ州、ビクトリア州と南オーストラリア州の除草剤耐性キャノーラ畑に隣接した在来種の畑63箇所から種子を採取した。 この3箇所でオーストラリアのキャノーラ畑の半分を超える面積になり、広く様々な環境を代表している。花粉の供給源と受け取り側の面積はほぼ同じで、25から100ヘクタールの広さである。収穫期に、各々の在来種の畑から最低10万個の種子を含むサンプルをGMキャノーラ畑から色々な距離で10個ずつ採取した。 GM畑と平行に最も近いところ、中間、最も遠いところから採取した。集めた種子サンプル(各500g)は、それぞれ別の圃場に植え、対照として除草剤耐性種と在来種を各2個所で栽培した。GM畑から受け取り側の畑に花粉を媒介にした遺伝子流出があったかどうかを調べるために、それぞれの芽生えを、致死濃度のALS阻害除草剤クロールスルフロン(chlorsulfuron)で処理し、14日後に再度処理して生き残ったものを確認した。
全サンプルの30%だけが除草剤耐性で、残りは非耐性であった。耐性の割合は最大0.197%までであった(図1)。サンプルを畑毎にまとめれば63%が耐性となったが、混入率0.03%以上のものは少なかった(図2)。この結果は、多くの場合、花粉を媒介にした遺伝子の流出は起こり得ることを示している。しかしながら、オーストラリアにおける商業栽培の畑の近くでさえ、遺伝子流出は1%以下である。 花粉の供給源から3Km以上では耐性遺伝子流出は検出されなかった。もっとも、このグループのサンプル数は少なかったが(図2)。

図1:距離と除草剤耐性種子の%。
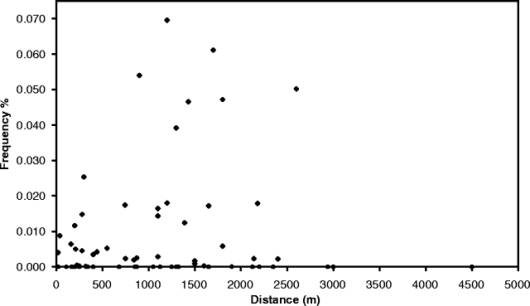
図2:距離別に各畑のサンプル(63箇所)をまとめた場合の距離と混入率%
これまでの研究(2,4,6,8)によれば、除草剤耐性は他の耐性を与える要因がなければ、非常に強力な遺伝子マーカーである。 ALS除草剤耐性に関しては、自然発生的な低レベルの耐性が報告されている(9)。このレベルは我々が以前行った実験で、オーストラリアのKaroo種に10―6
の頻度で見つかっている(データなし)。他の汚染源はないであろう。なぜなら、畑で検出された耐性の最大頻度が0.07%で、70万個の芽生えを検査したにもかかわらず、23個所では耐性株は見つからなかったからである。
これまでの花粉の移動実験では全て「周縁効果(Edge effects )」が見つかっていて、供給源に近いほど交雑の頻度が高いといわれている(4、6、10、11)。しかしながら、この実験では、同一の畑の内部のサンプル同士を比較しても、周縁効果は見つからなかった。即ち、GM畑に最も近い場所の散布が必ずしも高い耐性を示すとは限らない。除草剤耐性畑から100メートル以内では、3個所全てが同じような耐性頻度を示した(図3)。
全体として、ある畑では距離が離れれば頻度は下がるが、大部分の畑、特に供給源から遠い場合は混入率はばらばらである。この大規模野外研究において観察された周縁効果は押しなべて低く、交雑の結果に影響を与えるようには見えない。
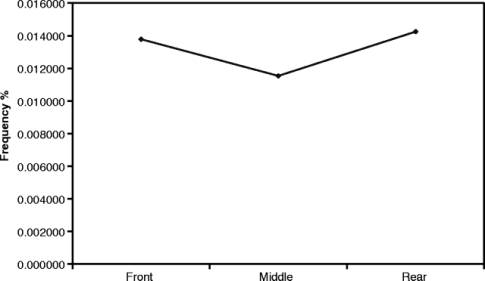
図3:GM畑から100メートル以内の3地点(近く、中間、遠方)から採取した種子の除草剤耐性頻度(%)
この研究はいくつかの点でユニークである。商業用の大規模な畑で実施されたこと、サンプル数が多いこと、オーストラリアの全面積の3分の1を超え、大半の環境をカバーする面積で行われたこと、である。この調査のもう1つのユニークな点は、花粉の供給源が大規模であること(25〜100ヘクタール)で、これまで行われた比較的小規模な野外実験とはことなる。小規模の人工的な花粉供給源ではなく、商業的な大規模な畑を利用して、花粉供給源から3キロまで花粉媒介による少量の遺伝子流出が起こることが明らかになった。我々は、多くの小規模実験で見られる急尖的な、エクスポネンシャルな(汚染の)減衰傾向(1、5、10、12)は観察できなかった。代わりに、より変化に富んだ交雑分布を検出した。 キャノーラの花粉による交雑に影響を与える多くの要因(風や昆虫)と花粉供給源のサイズの大きさが遠距離交雑のばらつきに影響しているかもしれない。GM遺伝子受け入れ側の畑のキャノーラの品種の違いも認められた(図4)が、花粉媒介の遺伝子流出に対する風向の影響に一貫性は認められなかった(データなし)。
キャノーラの品種の違いは距離別の交雑のばらつきに影響しているかもしれない。作物の品種が交雑に影響することは報告されている(12)。品種によって開花期が違えば、こうした大規模な交雑では影響を与えるだろう。また、こうした交雑率における見かけのばらつきは昆虫の行動にも左右される。媒介昆虫は畑の中の開花の早い植物や遅い植物だけをターゲットにし、その結果散発的な花粉の移動をもたらす。しかしながら、昆虫は充分な資源(すなわち花など)があり容易に利用できれば、同一の畑の中にとどまるものである(13)。
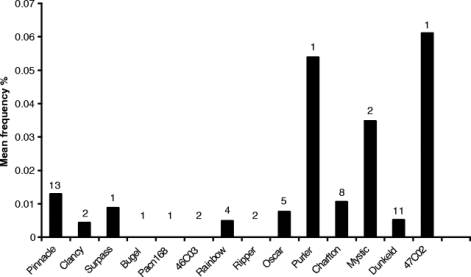
図4:キャノーラの品種による除草剤耐性獲得%。バー上の数字は調査した畑の数。
遺伝子の伝達は複雑なプロセスであって、環境条件、植物の品種、昆虫の行動、植物の密度など多くの要因に左右される(14〜16)。これらの観察と我々の長距離花粉移動データと合わせて考えれば、実験室の小規模実験からは必ずしも商業的な条件下の花粉による交雑を予想できないことを示している。この研究は商業用キャノーラ畑間の交雑が頻度は低いが相当の距離まで起こることを証明している。
引用文献とノート
1.J.
Champolivier, J. Gasquez, A. Messean, M. Richard-Molard, in Gene Flow and
Agriculture--Relevance for Transgenic Crops, P. Lutman, Ed. (British Crop
Protection Council, University of Keele, Staffordshire, UK, 1999), pp. 233-240.
2.R. Downey, in
Gene Flow and Agriculture--Relevance for Transgenic Crops, P. Lutman, Ed.
(British Crop Protection Council, University of Keele, Staffordshire, UK,
1999), pp. 109-116.
3.E. Paul, C.
Thompson, J. M. Dunwell, Euphytica 81, 283 (1995) .
4.J. A.
Scheffler, R. Parkinson, P. J. Dale, Plant Breed. 114, 317 (1995) [ISI].
5.G. R. Stringham
and R. K. Downey, Can. J. Plant Sci. 58, 427 (1978) .
6.B. Staniland,
et al., Can. J. Plant Sci. 80, 521 (2000) .
7.L. Hall, K.
Topinka, J. Huffman, L. Davis, A. Good, Weed Sci. 48, 688 (2001) .
8.C. Thompson et al., in Gene Flow and
Agriculture--Relevance for Transgenic Crops,P. Lutman, Ed. (British Crop
Protection Council, University of Keele, Staffordshire, UK, 1999), pp. 95-100.
9.C. Preston and
S. Powles, Heredity 88, 8 (2002) [CrossRef][Medline] .
10.G. Rakow and
D. Woods, Can. J. Plant Sci. 67, 147 (1987) .
11.J. Scheffler,
R. Parkinson, P. Dale, Transgenic Res. 2, 356 (1993) .
12.E. Simpson, C. Norris, J. Law, J. Thomas, J.
Sweet, in Gene Flow and Agriculture--Relevance for Transgenic Crops, P. Lutman,
Ed. (British Crop Protection Council, University of Keele, Staffordshire, UK,
1999), pp. 75-82.
13.J. Eckert, J.
Agri. Res. 47, 257 (1933) .
14.J. E. Barton
and M. Dracup, Agron. J. 92, 797 (2000) [Abstract/Full Text].
15.N. C.
Ellstrand, H. C. Prentice, J. F. Hancock, Ann. Rev. Ecol. Syst. 30, 539 (1999)
.
16.M. Rieger, C.
Preston, S. Powles, Aust. J. Agric. Res. 50, 115 (1999) .
17.We would like to thank P. Salisbury, S. Fisher,
and W. Burton (Agriculture Victoria); S. Sutherland, P. Parker, P. Mathews, and
G. Condon (New South Wales Department of Agriculture); and D. Lorraine-Colwill,
B. Mack, and S. Garvie (Adelaide University) for the collection of the seed
samples. We would also like to thank all the farmers who participated in this
study. WAHRI is an initiative of the Grains Research & Development
Corporation. 8 March 2002; accepted 13 May 2002