課題2及び3に関する報告書(註)
遺伝子組換え大豆の組換え遺伝子はヒトの小腸をそのまま通過するが、大腸では完全に分解
Trudy Netherwood、Susana M. Martín-Orúe1, Anthony G. O’Donnell, Sally
Gockling1, Harry J. Gilbert and John C. Mathers
Department of Biological and Nutritional
Sciences and Department
of Agricultural
and Environmental Sciences, University of
Newcastle upon Tyne,
Newcastle upon Tyne NE1 7RU, U.K.
(全訳 河田昌東)
(要約)
人間の食物連鎖の中に遺伝子組換え植物が入りこむようになって、人間の健康に対するリスクがあるかどうかに関し、大きな議論が生じている。人間の食糧に遺伝子組換え植物が含まれることによる大きな問題の1つは、均衡のとれた腸内細菌及び(又は)腸管内壁の表皮細胞に、組換え遺伝子が組み込まれる可能性があるかどうかで、両者とも健康に影響を与えるからである。最近のデータでは、組換え遺伝子のかなりの部分が試験管内の小腸シミュレーションでは生き残り(7)、マウスの腸に強制的に注入されたバクテリオファージM13のDNAが糞や血液、肝臓で検出されている(3,4,8)。 しかし、食物中の組換え植物由来のDNAが人間の場合存続できるかどうかはまだわかっていない。本研究で、我々は人間の胃腸管を通過する際に組換え遺伝子が生き残るかどうかを評価した。小腸を通過したDNAを追跡するために、7名の大腸切除手術を受けた人に遺伝子組換え大豆を含む食事を一回だけ与え、瘻孔(訳注:手術によって作った開口部のこと。人工肛門)から採取した消化物に組換えDNAが現れるかどうかモニターした。
小腸を生き残って通過した組換え遺伝子の量は、被験者によって相当ばらつきがあったものの、DNAは7名全員に検出された。一人の被験者の場合、組換えDNAは摂取した量の3.7%にも及ぶ多量が瘻孔から回収された。2回目の試験では正常の胃腸をもつボランテイアに1回だけ遺伝子組換え植物を含む食事を与えた。この場合は糞に組換えDNAが検出されず、完全な胃腸を通過すればDNAは生き残らないことを示している。
(本文)
7名の大腸切除手術を受けた人を募り、普通の食料品店で買った組換え食品を含む食事を与えた。この植物(大豆)に含まれる組換え遺伝子(epsps)は、アグロバクテリウムsp.CP4株由来の5‐エノ−ルピルビルシキミ酸−3‐リン酸シンターゼ(EPSPS)遺伝子を、ミトコンドリアの輸送信号であるペチュニアCTP遺伝子に連結したものである(9:訳注 モンサント社の除草剤耐性大豆遺伝子を示す)。この組換え遺伝子は、スチューダーらが報告している拮抗PCR法でRR04/RR05プライマーを使って定量的に検出できた(10)。湿重454グラムの食事には、組換え遺伝子が3×10の12乗コピー含まれていた。この食事には消化の度合いを測るマーカーとして不消化性PEG400を混ぜ、実験の過程で小腸を通過した食事の割合を決定した。7名の被験者の中6名で瘻孔から採取した消化物の中から90%以上のマーカーが回収出来た。
表1と図1に示すように、組換え遺伝子はどの被験者からも回収されたが、消化物の通過の割合と核酸(DNA)の全回収率は人によって大きくばらついた。被験者No3の組換え遺伝子回収率が低いのは、不消化性マーカーの回収率の低さから考えて、消化物の流れが非常に遅いことが原因である。しかしながら、被験者No7から採取した試料ではもとの食事に含まれていた180塩基対のepsps遺伝子カセットの3.7%に当たる1.1×10の11乗もの多量の組換え遺伝子が検出されたことは注目に値する。
epsps 遺伝子断片の残留は消化物の通過時間とは相関がなかった(図2)。このことは組換え遺伝子の回収率の変動には他の要因が関係していることを示唆する。膵臓から分泌されるDNAase1(訳注:DNA分解酵素-1)の量や胃液に分泌される胃酸の量に個人差があることで組換え遺伝子の生存のばらつきを説明出来るかもしれない。
次にepsps 遺伝子が完全な形で小腸を通過するかどうか調べるために、サンプルをGMS01と35S1のプライマーを使ったPCRにかけた。こうすれば完全なオープン・リーデイング・フレーム(訳注:導入蛋白質の合成に必要な構造遺伝子とその前後の読み取りに必要な配列を含むもの)が増幅される(10)。拮抗PCRからは有意味な結果が得られた。即ち、消化物の乾燥重量1mgあたり(プライマーの)180塩基対断片を少なくとも10の4乗コピー以上含む、完全長の組換え遺伝子が検出できた。
組換え遺伝子の生存率が、宿主大豆DNAの生存率とパラレルでなかった可能性はある。それを評価するために、宿主大豆のレクチン遺伝子、Le1(11、12)を増幅してみた。そのデータではLe1の遺伝子の生存率はepsps遺伝子のそれと同じであり(図3)、組換え遺伝子は大豆自身のDNAと同じ速さで分解されたことを示している。組換え植物のDNAがかなり大量に小腸を生き残ったまま通過したことは、胃で脱プリン反応が起こったり(訳注:DNAの中のアデニンやグアニンなどのプリン塩基が強酸中ではDNA鎖から除去される現象)、腸管内で膵臓のDNA分解酵素が高いレベルで存在することを考えれば、驚くべきことである。胃内で組換え遺伝子が比較的安定なことは、何らかの形で食物マトリックス(訳注:DNAがヒストンその他の蛋白質や糖などの成分で覆われ、直接分解酵素や酸にさらされにくい構造)が出来たために、DNAの周りの水素イオン濃度が平均的な胃腸内の濃度ほど高くなるのを妨げる緩衝効果があったことを示すかもしれない。 DNA分解酵素による攻撃にたいして組換えDNAが保護されたのは、DNAがヒストンと非常に強く結合していることの反映の可能性がある。特にゲノム中の構造がしっかりしているヘテロクロマチン領域ではそうである。あるいは、遺伝子組換え植物では何らかの細胞内構造が細胞内DNAをDNA分解酵素から保護している可能性もある。しかし、この説明では裸の大豆DNAが試験管内で加工大豆食品(今回使ったものと同じ)中のDNAと同じ速さで加水分解される事実を説明できない。何故なら、この場合は植物の細胞内構造が壊れていることを示すからである(7)。
組換え植物から腸内細菌に遺伝子伝達があるかどうかを評価するために、大腸内消化物の中の腸内細菌を、グリフォサートを含むルリア栄養培地(通称LB培地)で6回の継代培養を行った。各培養地には1ミリリットル当たり10の8乗個の細菌が繁殖した(訳注:即ちグリフォサート耐性菌が1億個/ml いた)。
被験者No.1(食事後18分)と4(同240分)、7(同300分)から採ったサンプルに由来する培養地には、プライマーRR04とRR05を使って180塩基対のPCR生産物が作られた(10)。PCRで増幅されたDNAには組換え遺伝子由来の配列がはっきりと確認された。これらの被験者が組換え体の食事をとる前に(実験からゼロ分経過)採取されたサンプルからはこうしたPCR産物は検出されなかったが、このサンプル中の細菌を、グリフォサートを含むLB培養地で培養したところ、非常に低濃度ではあったが第1世代の培養から組換えDNAのPCR産物が明らかに検出された。 重要なことは、勢力的に探したにもかかわらず、コロニー・ブロット・ハイブリダイゼーション法やPCRプール法で組換え遺伝子をもつ細菌を単離出来なかったことで、これらの被験者達の本来の腸内細菌には組換え遺伝子をもつ細菌がいるにしてもその割合は非常に低い、ということである。
組換え植物の遺伝子が完全な胃腸管を経由しても生き残るかどうか調べるために、さらに12名のボランティアに組換え食品を食事を与え、糞中に組換え遺伝子があるかどうかPCRで調べた。これらの被験者からは不消化性マーカーは90%以上回収され、食事は小腸と大腸を通過したことを示しているが、組換え遺伝子はどの被験者からも検出できなかった。この結果が、PCR増幅反応の阻害によるものでないことは、epspsを含むプラスミドを触った針で採った糞では180塩基対のプライマー生成物が作られたことからも証明される。糞から採った細菌を好気的および嫌気的条件下で培養しても、PCRの結果は組換え遺伝子が無いことを示していた。これらのデータは、組換え遺伝子は小腸を生きたまま通過するが、大腸で完全に破壊される、ということを示している。このことは、人間の大腸に似たエコシステムをもつ腸内細菌のDNA分解酵素のレベルは非常に高いので、裸のDNAは特に急速に分解される、という過去の研究とも附合する(13、14:H.J Flintの個人情報)。
完全な胃腸管を持つ被験者の糞から培養した細菌に組換え体由来の遺伝子が検出されなかったことは注目に値する。これは大腸切除手術患者の小腸の組換え遺伝子を持つ細菌が人間の大腸を通過する間に生き残らなかったことを示唆する。この結論はしかしながら注意深く考察しなければならない。何故なら、大腸切除患者の小腸の生理学的条件が、植物成分からの腸内細菌への遺伝子伝達に影響を与える、といったふうに正常な胃腸の人のそれとは異なる可能性があるからである。
例えば、大腸切除患者は膵臓から分泌されるDNA分解酵素の量が少なく、DNAの分解が低下し、その結果組換え遺伝子の腸内細菌への遺伝子伝達の確率が増加する、といった具合である。あるいは、大腸切除患者と正常人とは消化物の通過速度や、小腸の細菌生態系の構造が全く異なるかもしれない。
人間の食品中の遺伝子組換え体に関するもう1つの懸念は、組換え遺伝子が細菌を経由して腸の表皮細胞に伝達されるのではないか、ということである。そうした遺伝的伝播の可能性が最も高いベクターは、腸嚢胞表面にコロニーを形成する乳酸菌(15)や細胞内病原体のサルモネラ菌(Salmonella
typhimurium)(16)である。実際、サルモネラ菌の細胞内存在が単白球/マクロファージを標的とした遺伝子治療でサルモネラ菌をベクターとして採用する結果をもたらしている(17)。そうした遺伝子伝達の可能性を評価するために、Lactabacillus
GG株ととS.typhimurium SL3261株をそれぞれ pBK-CMV と pLN1で形質転換した。どちらのプラスミドも抗生物質ネオマイシンの耐性遺伝子を持っていて、全ての哺乳類細胞で活性を示すSV40ウイルスの初期プロモーターでコントロールされている。これらの細菌を腸細胞モデルであるCaco-2細胞とともに培養し、遺伝子操作した2種類の原核細胞から哺乳類細胞のゲノムに遺伝子伝達があるかどうか、G418(ネオマイシンのアナログ)耐性のCaco-2細胞で選択した。pBKCMV
または pLPNによるトランスフェクションでは Caco-2細胞はG418に対して3000分の1の頻度で耐性を獲得した。これに対し、10の7乗個のCaco-2細胞を、色々な分化の段階で、それぞれの組換えプラスミドを持つ1000倍過剰のS.
typhimurium SL3261 又actabacillus GGと共に培養しても、G418耐性の哺乳類細胞は生じなかった。これらのデータは、遺伝子組換え植物から腸管上皮細胞への遺伝子伝達は、直接であれ、あるいは腸内細菌を通じてであれ、起こりそうもないことを示している。組換え食物を含む食事をした被験者の糞から組換え遺伝子が見つからなかったことはこの見解をさらに支持するものである。何故なら糞は通常相当量の剥離した大腸細胞を含んでいるからである。
この結果は裸のバクテリオファージDNAが哺乳類の腸細胞に取り込まれ、体の他の組織にさえ現れるという、シュバートらのマウスを使った実験(6)と矛盾する。マウスの胃腸管は人間よりも(DNAを)取りこみやすいかもしれないし、あるいはマウスの胃腸管に挿入されたDNAの量が我々の行った人間の食物を与える実験よりも多量の核酸を含んでいたかもしれない。したがって、マウスのデータは人間の食物のDNAの行方を正確には反映していない。
この報告書は、遺伝子組換え食品の中の組換え遺伝子が小腸をそのまま通過するが大腸で完全に分解されることを示した。組換え食品から小腸の腸内細菌に遺伝子伝達が起こった証拠はあるが、この伝達は直前に遺伝子組換え食物を被験者が食べたことを反映していて、植物由来のDNA配列を含む細菌群は腸内細菌全体からみれば極めて少ない。このデータは、腸管上皮細胞や腸管内細菌への遺伝子伝達を通じて人間の健康に与える危険性は少ない、という見解を支持する。
実験方法と材料(訳を省略)
|
図1 遺伝子組換え食品の中のepsps遺伝子の構成 |
|||
|
|
|||
|
|
カリフラワー・モザイク・ウィルスの35Sプロモーター |
||
|
|
ペチュニアのCTP遺伝子 |
|
epsps遺伝子 |
|
|
NOS3’終止信号 AはPCR増幅用プライマー Bは完全長の遺伝子検出用 |
||
表1 大腸切除患者の小腸における組換え遺伝子epspsの残存
|
|
組換え遺伝子のコピー数(×10の5乗) |
||||||
|
摂取後時間(分) |
被験者1 |
被験者2 |
被験者3 |
被験者4 |
被験者5 |
被験者6 |
被験者7 |
|
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
30 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
|
60 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
90 |
0 |
0 |
25 |
340* |
0 |
0 |
0 |
|
120 |
0 |
1720* |
0 |
380* |
51 |
0 |
0 |
|
150 |
0 |
210* |
0 |
460* |
23 |
0 |
4700* |
|
180 |
250* |
0 |
0 |
3790* |
330* |
0 |
2300* |
|
210 |
430* |
0 |
0 |
8200* |
630* |
523* |
7000* |
|
240 |
140* |
0 |
0 |
93000* |
490* |
3200* |
410* |
|
270 |
160* |
0 |
0 |
4100* |
250* |
10200* |
0 |
|
300 |
110* |
0 |
0 |
230* |
5 |
12340* |
0 |
|
330 |
180* |
0 |
0 |
470* |
0 |
4600* |
0 |
|
360 |
14 |
0 |
0 |
420* |
0 |
2700* |
0 |
|
*印は完全長(フルサイズ)のepsps遺伝子が検出されたサンプル |
|||||||
図2a 組換え遺伝子の回収率



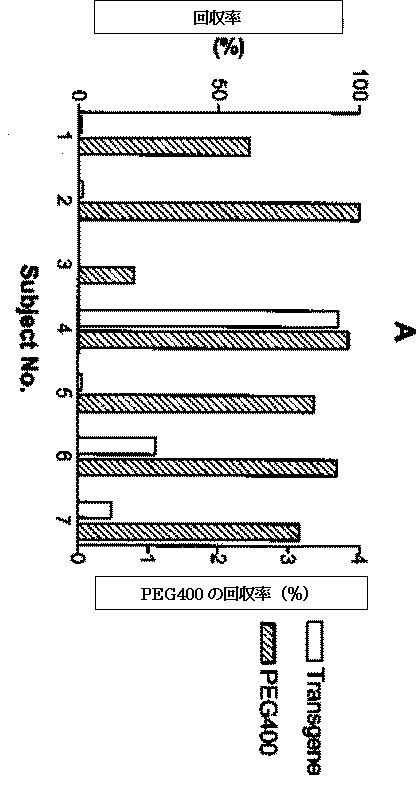

図3 組換え遺伝子epspsと大豆レクチン遺伝子Le1の回収率(回帰係数0.9507)
文献
1 Padgette, S. R.,
Kolacz, K. H., Delannay, X., Re, D. B., Lavallee, B. J., Tinius, C. N., Rhodes,
W. K., Otero, Y. I.,
Barry, G. F., Eichholtz, D.
A., Peschke, V. M., Nida, D. L., Taylor, N. B. and Kishore, GM. (1995) Crop
Science 35,
1451-1461
2 Koziel, M. G., Beland,
G. L., Bowman, C., Carozzi, N. B., Crenshaw, R., Crossland, L., Dawson, J.,
Desai, N., Hill,
M., Kadwell, S., Launis,
K., Maddox, D., McPherson, K., Meghji, M. R., Merlin, E., Rhodes, R., Warren,
G. W.,
Wright, M. and Evola, S.
V. (1993) Bio-Technology 11, 194-200
3 Schubbert, R.,
Lettmann, C. and Doerfler, W. (1994) Molecular and General Genetics 242,
495-504
4 Schubbert, R., Renz, D.,
Schmitz, B. and Doerfler, W. (1997) Proceedings of the National Academy of
Sciences
U.S.A 94, 961-6
5 Beylot, M. H., Emami,
K., McKie, V. A., Gilbert, H. J. and Pell, G. (2001) Biochemical Journal 358,
599-605
6 Kellett, L. E., Poole,
D. M., Ferreira, L. M., Durrant, A. J., Hazlewood, G. P. and Gilbert, H. J.
(1990) Biochemical
Journal 272,
369-76
7 Martin-Orue, S.,
O'Donnell, A. G., Arino, J., Netherwood, T., Gilbert, H. J. and Mathers, J. C.
(2002) British Journal
of Nutrition in the
press
8 Schubbert, R., Hohlweg,
U., Renz, D. and Doerfler, W. (1998) Molecular and General Genetics 259,
569-76
9 Barry, G. F., Kishore,
GM., Padgette, S. R. and Stallings, W. C. (1997) in U.S. Patent 5627061-A9
10 Studer, E., Rhyner,
C., Lüthy, J. and Hübner, P. (1998) Zeitschrift fur Lebensmittel-Untersuchung
und-Forschung AFood
Research and Technology 207,
207-213
11 Meyer, R.,
Chardonnens, F., Hubner, P. and Luthy, J. (1996) Z Lebensm Unters Forsch 203,
339-44
12 Vodkin, L. O., Rhodes,
P. R. and Goldberg, R. B. (1983) Cell 34, 1023-31
13 Ruiz, T. R., Andrews,
S. and Smith, G. B. (2000) Canadian Journal of Microbiology 46, 736-40
14 Sharp, R., Hazlewood,
G. P., Gilbert, H. J. and O'Donnell, A. G. (1994) Journal of Applied
Bacteriology 76, 110-7
15 Adlerberth I., A. S.,
Johansson M. L., Molin G., Hanson L. A., Wold A. E. (1996) Applied and
Environmental
Microbiology 62,
2244-2251
16 Hoiseth, S. K. and D.,
S. B. A. (1981) Nature 291, 238-239
17 Paglia, P.,
Terrazzini, N., Schulze, K., Guzman, C. A. and Colombo, M. P. (2000) Gene
Therapy 7, 1725-1730
18 Hidalgo, I. J., Raub,
T. J. and Borchardt, R. T. (1989) Gastroenterology 96, 736-49
19 Kerovuo , J. and
Tynkkynen, S. (2000) Letters in Applied Microbiology 30, 325-9
20 Soole, K. L., Hall,
J., Jepson, M. A., Hazlewood, G. P., Gilbert, H. J. and Hirst , B. H. (1992)
Journal of Cell Science
102, 495-504
訳注(河田昌東)
この報告書は、英国食品基準庁のプロジェクト(G010008:遺伝子組換え生物を人間の食物に利用することに伴うリスク評価)の諮問により、ニューカッスル大学の研究者らが行った研究結果である。この報告書の結論部分は極めて政治的解釈の色彩が強く、結論だけみれば遺伝子組換え食品の摂取のリスクは低い、と主張している。しかし、この論文の内容の意味するところは極めて重大である。
この研究で明らかになった最も大きな点は、組換え遺伝子(モンサントのラウンドアップ耐性遺伝子epsps)が胃腸内でほとんど分解されずに、ほぼ100%が大腸にまで到達する、という事実である(表1、図2a)。これまで国の安全審査では、組換え遺伝子及びその蛋白質は合成胃腸液による消化実験で、数分以内にほとんど分解するので、腸内細菌への遺伝子伝達や、アレルギーの危険はないとされてきたが、この実験はこうした主張を完全に覆した。試験管実験だけの判断がいかに危険か明らかになった。 国の安全審査はこの一点でもやりなおす必要がある。
第2の問題は、組換え遺伝子が明らかに小腸内の細菌に遺伝子伝達され、グリフォサート耐性の菌が発生したことである。しかしこの事実は一見奇妙である。何故ならepsps遺伝子には真核細胞で発現するカリフラワー・モザイク・ウィルスのプロモーターが結合しているはずであり、原核細胞の細菌内では発現しないはずだからである。しかし、発現が事実であれば、epsps遺伝子は細菌内で再組換えを起こし、細菌自身のプロモーター結合した疑いもある。このように組換え遺伝子が分解しないままフルサイズで細菌に伝達することが事実であれば、これまでたびたび言われてきた「抗生物質耐性マーカー」遺伝子が細菌に組み込まれ、抗生物質耐性菌が発生することは極めて容易である。今回の実験に使ったモンサント社の除草剤耐性大豆には抗生物質耐性遺伝子が含まれていないが、単独では選択マーカーにならない他の多くの遺伝子(例えばBt)を含む組換え体は抗生物質耐性遺伝子を持っており、それ自身が細菌のプロモーターに連結している。これが細菌内に取りこまれれば、間違い無く耐性菌が発生すると考えられる。
第3に、この研究ではたった1食の組換え大豆を含む食事をしただけで、こうした結果が得られたわけで、もし日常的に食べ続けることを考えれば、事態はさらに深刻になるはずである。
第4に、小腸ではほとんど分解されずに存在する組換え遺伝子が、大腸で忽然として消えてしまうのはなぜか。この問題は今後も追及する必要があるが、普通の生活者からすれば、大腸の機能が不充分で例えば下痢などの場合、ほとんど小腸の内容物が出てくることはありうる。したがって、たった7名の人体実験をもって大腸で完全に分解する、と結論するのは早計である。
この研究はこれまで単に理論的可能性として論じられてきた「腸内細菌の遺伝子伝達による抗生物質耐性獲得の危険性」がはっきり現実的な危険性であることを示した点で画期的である。この論文と同時に公開するメイワンホー博士の批判も参考にして欲しいと考える。
